蛋白质作为生命活动的物质承担者,对阐述生命体的变化机制具有重要作用,近年来对于其组学技术的研究发展迅速,在过去的一年之中,就有75篇蛋白质组学、及蛋白质修饰组学技术相关研究成果在国际顶级期刊Cell,Nature发表,在各个领域接连取得重大突破。
来源:转化医学网
相较于其他组学,人类蛋白组在结构、组成和数量变体上更加复杂多样,在人体中超过一百万种蛋白质变体,研究正常及病理体间的蛋白质性质、丰度的差异,发现疾病相关的特定蛋白质分子,尤其是许多癌症的有效诊断性标志物,对疾病的诊断意义巨大,也是支撑后基因组学的重点研究方向之一。
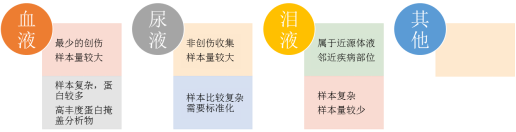
生命过程中的功能蛋白、重大疾病的蛋白标志物往往在生物本体中丰度较低。用于蛋白质研究的样品选择取决于具体待解决的临床问题、样品的可用性和生物模型的局限性。血液是最丰富的体液,并且很容易通过静脉穿刺以最小的侵袭程度采集,是最适用于生物标志物筛查、诊断或监测应用的生物体液。然而,血浆或血清的蛋白质组分析非常具有挑战性,这是因为存在于血液中的低丰度蛋白质往往被高丰度蛋白质掩盖,22种高丰度蛋白质构成了总蛋白质质量的99%。
生物质谱&纳米材料
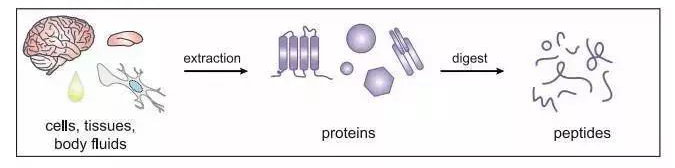
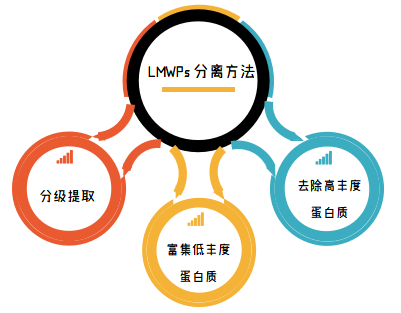
研究蛋白组学首要任务就是从预处理的样本之中分离出蕴藏着大量基因表达及代谢信息的低分子量蛋白质/肽(LMWPs),并利用各种色谱与质谱技术进行分析。
来源:科学网
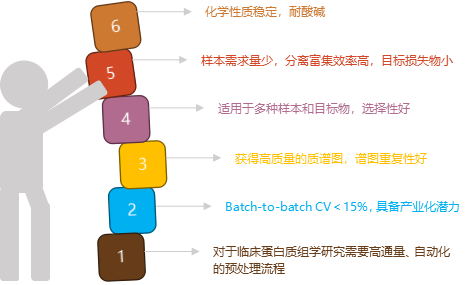
基于生物质谱的蛋白组学研究,首要解决的问题就是样本预处理,在质谱进样前使所要研究的蛋白质和多肽得到有效的酶解和分离富集,以简化分析体系的复杂程度。蕴含疾病信息的LMWPs极易受外界环境干扰,在捕获富集的过程中也要防止一些蛋白酶对其降解。另外,脂质和盐的存在会对质谱分析有一定的干扰。去除高丰度蛋白质和大量的馏分可能会提高对低丰度蛋白质的检测,但是会降低分析的通量和再现性。因此,在分离富集过程中,分离材料的合成或选择已成为影响分析灵敏和选择性的核心因素,理想的分离富集材料需具备以下特性:
传统的分离研究主要致力于新型柱材料、膜材料以及微米级填料的开发和修饰,以满足不同的分离分析和样品预处理的需要,但在分离富集效率和选择性上仍具有较大局限性。纳米材料可以通过形貌调控和功能复合在纳米维度针对分离富集需求进行构筑,且通过表面形貌的设计和修饰来不断对分离效果进行调节和优化,因此具备了巨大的应用潜力和广阔的应用前景。
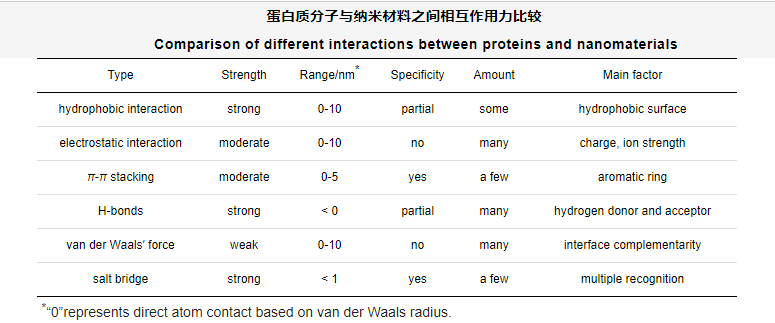
纳米材料具有易于制备和进行表面修饰、比表面积大、提供丰富的结合位点等优点,其表面功能化主要通过两种途径:一是通过非共价相互作用,包括物理吸附和包裹,将生物分子修饰于纳米颗粒表面,二是通过共价相互作用将功能基团连接到纳米颗粒表面。目前研究较多的主要有:介孔材料、纳米金属氧化物、功能化金属纳米颗粒,应用于质谱检测前生物样本中低丰度蛋白多肽、蛋白翻译后修饰如磷酸化、糖基化蛋白/肽段的分离富集。
孔径在2-50nm之间的纳米材料称为介孔材料,因其均一的孔道结构,可通过对孔径的调节对分子质量较小的多肽进行选择性富集,而将高分子质量的蛋白质去除。

普通介孔碳材料
大部分介孔材料以硅基、碳基为骨架,具有良好的化学稳定性。疏水-疏水互相作用原理是分离LMWPs的主要驱动力,碳纳米材料具有良好的疏水性和较大的比表面积,并通过磁性和介孔通道修饰,可对目标蛋白进行捕获。

OMC虽然相较于SPE和MCM材料具有较好的富集效率,然而由于碳材料表面吸附能力太强,导致选择性下降,且在洗脱过程中过造成多肽损失等问题,并不作为首选材料。
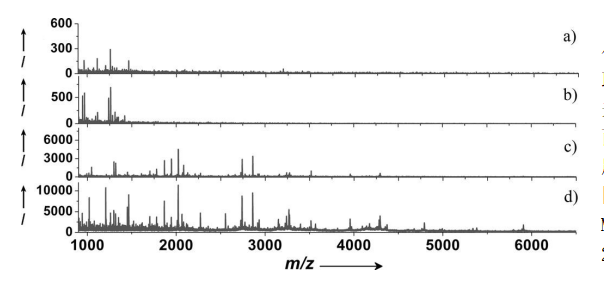
人血清肽的MALDI-TOFMS分析
a) 直接分析 b)UF/SPE c)MCM-41 d)OMC
金属氧化物富集法是分离富集低丰度磷酸化蛋白质常用方法之一。某些金属氧化物纳米材料,如TiO2、ZrO2纳米颗粒可通过桥氧键与磷酸肽中的磷酸基团特异性结合,因此可以高效地捕获富集磷酸肽,具有较好的特异性和选择性。
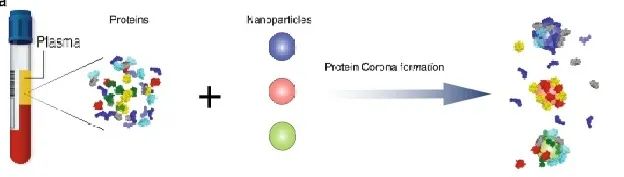
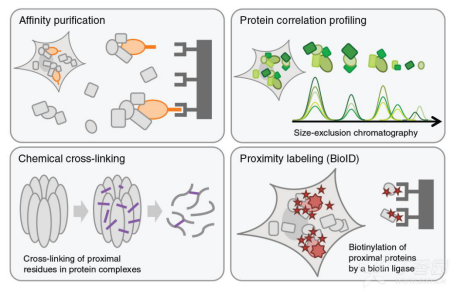
近年来,磁性纳米材料所特有的快速磁响应性能、化学稳定性、无毒性等也使得其在生物分离领域备受推崇。研究者通常将磁性纳米颗粒/微球作为内核,并对其进行功能化包覆和修饰后应用于多肽分离研究。近期Seer公司创始团队发表的论文中也提及了利用多种超顺磁性氧化铁纳米颗粒(superparamagnetic iron oxide,SPIONs,NPs),该NPs与蛋白组进行特定的相互作用,形成纳米颗粒表面的“蛋白冠”,对LMWPs进行富集、洗涤、洗脱等过程,最终获得低丰度蛋白质用于质谱检测。

全流程检测长达7个小时,检测精度:CV%分布基本稳定在25%左右,纯血浆18%,距离体外诊断行业15%的要求仍有一定差距。
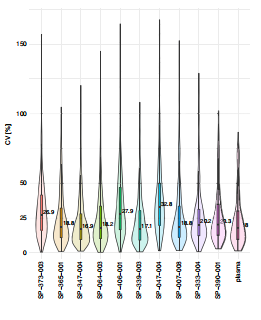
来源:Seer
对糖肽有特异性作用的基团物质合成/修饰至纳米材料表面,糖肽与纳米材料表面相互作用而被结合,通过离心或者磁性分离等合适方法将材料分离出来,再通过洗脱释放糖肽,从而将糖肽从复杂体系中高选择性分离出来并达到质谱可以检测的水平。功能化的金纳米颗粒、银纳米颗粒常用于糖肽富集,如利用金和巯基之间的相互作用在纳米金颗粒表面修饰上巯基苯硼酸,可发展血清样本中糖肽的靶上富集方法。
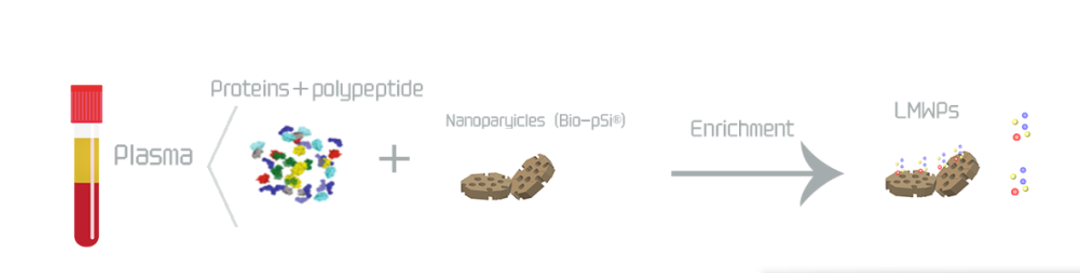
汇健科技研发的Bio-pSi®纳米材料,具有孔径高选择性、多维表面功能化、高稳定性等的特点,只需微升级样本可高效捕获LMWPs,在血清肽谱方面出峰稳定、质量可控,目前批间CV<15%可控,适用于血清、尿液、泪液等多种生物样本。

基于Bio-pSi®纳米颗粒开发的肽谱分析试剂盒,特别针对常规科研和临床蛋白质组学研究不同需求设计,适合样本体积小、批量样本预处理的场景应用,满足临床对高通量、高稳定性和选择性的需求。汇健科技致力于纳米科技与生物技术交叉融合创新,整合大数据和计算分析方法,系统揭示材料与生物分子相互作用的途径和机制,为不同领域提供材料信息技术和质谱多组学技术。
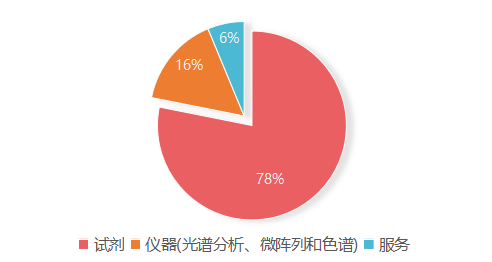
根据2019年Allied Markets Research统计,蛋白质组学市场的320亿美元中,试剂和仪器分别占250亿美元和50亿美元,共占据蛋白组学市场的百分之九十四,未来包括Seer在内的基于质谱平台的蛋白质组学公司研发重心都将落在试剂和仪器上。
Seer最近成立的子公司PrognomIQ,计划利用Proteograph产品平台为各大质谱仪厂商提供蛋白质组学分析技术。
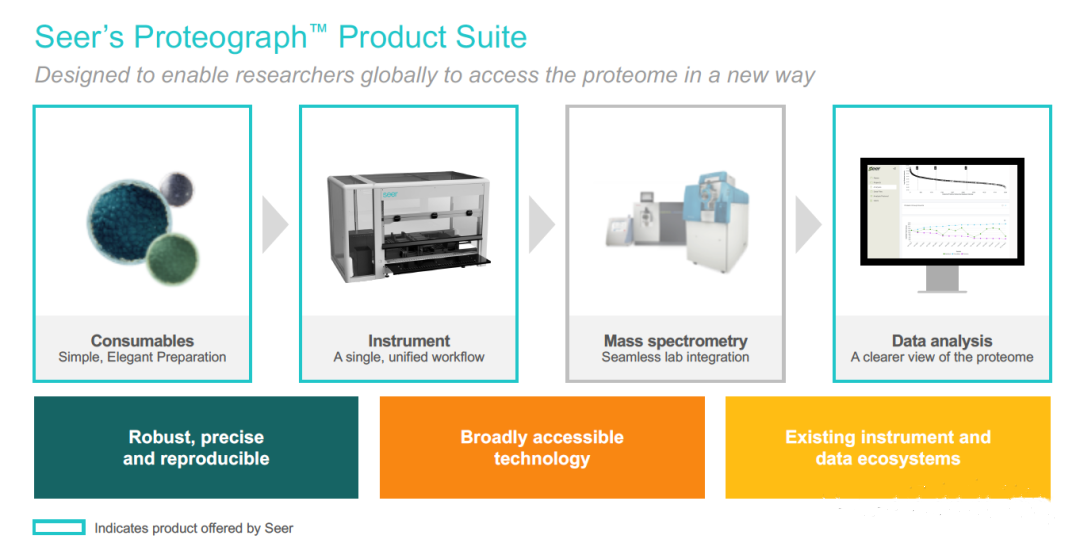
构建试剂和耗材、自动化仪器和数据分析软件为一体的检测系统是蛋白组学公司推进质谱产业化的重要一步。
 来源:汇健科技
来源:汇健科技
汇健科技基于“3T”精准诊断的一站式解决方案,利用ClinMS-Plat® I质谱仪与Bio-pSi® 纳米材料、汇健智云® AI分析软件构成国内首套肿瘤肽谱检测应用系统。

预计到2024年蛋白质组学市场将增长至640亿美元,年均复合年增长率为15%,是成长发展最快的组学之一,在未来市场,拥有以“试剂+软件+仪器”闭环体系构筑的坚实技术壁垒是企业在蛋白组学市场的核心竞争力。
参考文献
Yang S. T. ; Liu Y. ; Wang Y.W. ; Cao A. Small 2013, 9, 1635.
H. Q. Qin, P. Gao, F. J. Wang, L. Zhao, J. Zhu, A. Q. Wang, et al. Highly efficient extraction of serum peptides by ordered mesoporous carbon. Angew. Chem. Int. Ed., 2011, 50, 12218-21.
P. Yin, N. Sun, C. Deng, Y. Li, X. Zhang, P. Yang, Facile preparation of magnetic graphene double-sided mesoporous composites for the selective enrichment and analysis of endogenous peptides, Proteomics, 2013, 13,2243-2250.
Blume, J.E., Manning, W.C., Troiano, G. et al. Rapid, deep and precise profiling of the plasma proteome with multi-nanoparticle protein corona. Nat Commun 11, 3662 (2020). https://doi.org/10.1038/s41467-020-17033-7
Sun N , Wu H , Shen X , et al. Nanomaterials in Proteomics[J]. Advanced Functional Materials, 2019, 29(26):1900253.
《纳米分析化学》朱俊杰
公众号文章:Seer,蛋白质组学领域的 “Illumina”?
